Источник: Харитонов Андрей Геннадьевич
В перечне препаратов для лечения воспалительных заболеваний кишечника (ВЗК) пополнение. Американская FDA одобрила новый препарат для лечения язвенного колита (ЯК) средней и тяжелой степени у взрослых людей - мирикизумаб («Omvoh» от компании Lilly). Этот препарат является первым зарегистрированным лекарством от ЯК, нацеленным на субъединицу р19 интерлейкина-23. У нас уже есть препарат схожего действия (устекинумаб), но его действие направлено на субъединицу р40 интерлейкинов 23 и 12.
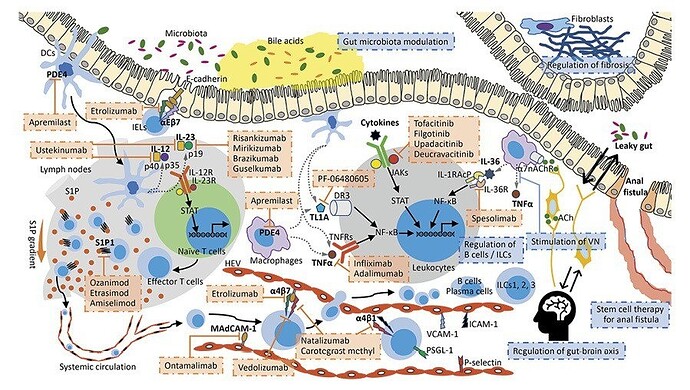
На этой сложной картинке мирикизумаб левее и выше центр.
Блокирование интерлейкина 23 приводит к сдерживанию дифференцировки, созревания и выживания иммунных клеток T-хелперов 17 типа, которые, будучи активированными, приводят к продукции воспалительных цитокинов.
Одобрение FDA было основано на результатах исследования LUCENT, в котором оценивалась эффективность и безопасность мирикизумаба у взрослых с ЯК средней и тяжелой степени. Все пациенты, участвовавшие в программе LUCENT, в прошлом получали лечение, которое не помогло, перестало действовать или которое они не могли переносить (включая “биологическую” терапию и лечение малыми молекулами).
Программа включала два рандомизированных двойных слепых плацебо-контролируемых клинических исследования 3 фазы.
Первое 12-недельное исследование (UC-1, 1281 пациент) оценивало вероятность достижения ремиссии, а в последующем 40-недельном исследовании (UC-2, 544 пациента) оценивалась эффективность препарата в поддержании ремиссии ЯК.
В протоколе UC-1 через 12 недель почти две трети (65%) пациентов, принимавших мирикизумаб, достигли клинического ответа по сравнению с 43% пациентов в группе плацебо. Почти четверть пациентов, принимавших мирикизумаб (24,2%), достигли клинической ремиссии по сравнению с 13,3% пациентов, принимавших плацебо. Исследователи обнаружили, что результаты стали лучше через 40 недель: половина (49,9%) пациентов, получавших мирикизумаб, достигли клинической ремиссии по сравнению с 25,1% в группе плацебо.
Мирикизумаб продемонстрировал благоприятный профиль безопасности в обоих исследованиях. Побочные реакции соответствовали ожидаемым в этой группе пациентов и отмечались как минимум у 2% пациентов с более высокой частотой, чем у плацебо. Наиболее частыми побочными реакциями (≥2%), связанными с индукционным лечением мирикизумабом, были инфекции верхних дыхательных путей и боль в суставах. Во время поддерживающего лечения наиболее частыми побочными реакциями были инфекции верхних дыхательных путей, реакции в месте инъекции, артралгия, сыпь, головная боль и герпетическая инфекция.
Препарат опять же не панацея, но перспектива для тех, кому не помогло другое лечение.
Ссылка на исследование тут: https://pubmed.ncbi.nlm.nih.gov/37379135/
![]()
Обратитесь к врачу
Мы стараемся бережно и тщательно собирать для вас информацию. Но помните: ответственность за ваше здоровье лежит на вас и на лечащем враче. Мы не выписываем рецептов, мы даем информацию. Полагаться на нее или нет - решать вам.